Медь: формула меди, масса меди, температура плавления, плотность, распределение электронов в атоме меди.
Медь ( Cuprum , синонимы: сopper, cuprum , формула Cu , торговые названия: медь; медь черновая; порошок медный электролитический, регистрационный номер CAS 7440-50-8, порядковый номер в таблице Д.И. Менделеева 29, атомная масса 63.546, Тплавл.1083 0 С, Ткип.2543 0 С, плотн.8,92-8,94г/см 3 . Распределение электронов в атоме меди 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1 . Существуют два природных изотопа меди 63 Cu и 65 Cu .)
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (Си O Н)2С O 3 . При нагревании на воздухе в интервале температур 200—375°С медь окисляется до черного оксида меди(II) СиО. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди( II ), а внутренний — красный оксид меди( I )| Си2 O . Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди, изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Получение меди в лаборатории:
Порошкообразную медь можно получить восстановлением из соединений меди металлами или водородом: CuSO 4 + Zn → Cu + ZnSO 4
Очень мелкодисперсную медь можно получить восстановлением оксида меди водородом:
Токсикологические свойства меди:
Клиническая картина острого отравления: при вдыхании – першение в горле, чихание, кашель, сладкий вкус во рту, головная боль, слабость, покраснение зева и конъюнктивы, тошнота, боли в мышцах, рвота, диарея, разбитость, озноб, высокая температура.
Наиболее поражаемые органы и системы: нервная, сердечно-сосудистая и дыхательная системы, желудочно-кишечный тракт, фосфорно-кальциевый обмен, печень, почки, кровь.
Раздражающее действие: на кожу: нет. На глаза: нет.
Первая помощь при отравлениях: при вдыхании – свежий воздух, покой, тепло. При попадании через рот – прополоскать ротовую полость водой, обильное питье воды, активированный уголь, солевое слабительное. При попадании на кожу – смыть проточной водой с мылом. При попадании в глаза – промыть проточной водой. В случае необходимости обратиться за медицинской помощью.
Нормативы : ПДК хоз.питьевой –0.1мг/дм 3 ; ПДК рыб. хоз.–0.001 мг/дм 3 , класс опасности–3
Формула меди
Медь характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 8,94 г/см 3 . Температура плавления 1084,5 o C, кипения 2540 o C.
Рис. 1. Медь. Внешний вид.
Химическая формула меди
Химическое обозначение меди – Cu от латинского слова «cyprum». Этот химический элемент расположен в четвертом периоде в IВ группе Периодической таблицы Д.И. Менделеева.Относится к элементам d-семейства. Металл. Относительная атомная масса меди равна 63,546 а.е.м.
Электронная формула меди
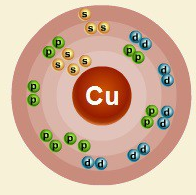
В ядре атома меди содержится 29 протонов и 35 нейтронов (массовое число равно 64). В атоме меди есть четыре энергетических уровня, на которых находятся 29 электронов (рис. 2).
Рис. 2. Строение атома меди.
Электронная формула атома меди в основном состоянии имеет следующий вид:
Примеры решения задач
| Задание | Определите простейшую формулу вещества, в котором массовые доли натрия, фосфора и кислорода составляют 34,59, 23,31 и 42,10% соответственно. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим число атомов натрия в молекуле через «х», число атомов фосфора через «у» и число атомов кислорода за «z».
Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(Na) = 23; Ar(P) = 31; Ar(O) = 16
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z = m(Na)/Ar(Na) : m(P)/Ar(P) : m(O)/Ar(O);
x:y:z = 34,59/23 : 23,31/31 : 42,10/16;
x:y:z = 1,5 : 0,75 : 2,63 = 2: 1 : 3,5 = 4 : 4: 7
Значит простейшая формула соединения натрия, фосфора и кислорода имеет вид Na4P4O7.
| Задание | Определите молекулярную формулу вещества, состоящего из кислорода, азота, фосфора и водорода, если известно, что оно содержит по массе 48,48% кислорода, число атомов азота в нем в два раза больше числа атомов фосфора, а количество атомов водорода в соединении в 2,25 раза больше количества атомов кислорода. Молярная масса вещества меньше 200 г/моль. |
| Решение | Обозначим число атомов кислорода в молекуле через «х», число атомов азота через «у», число атомов фосфора за «z» и число атомов водорода за «k». |
Найдем соответствующие относительные атомные массы элементов азота, фосфора, водорода и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(N) = 14; Ar(P) = 31; Ar(H) = 14; Ar(O) = 16
Пусть масса неорганического вещества равна 100 г, тогда масса кислорода составляет m(О) = 48,48 г. Найдем количество вещества кислорода:
n(О) = 48,48 / 16 = 3,03 моль
Согласно условию задачи n(Н) = n(О) ×2,25, т.е.
n(Н) = 3,03 × 2,25 = 6,82 моль
Тогда масса водорода будет равна:
m(Н) = 6,82 ×1 = 6,82 г
Найдем суммарную массу элементов азота и фосфора, входящих в состав соединения:
m (N + P)= 100 – 48,5 – 6,82 = 44,68 г
Запишем уравнения для нахождения массы каждого из элементов в отдельности:
Составим систему уравнений и решим ее:
28 n(Р) + 31n (P) = 44,68;
n(N) = 2× 0,75= 1,514 моль
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z:k = n(О) : n(N) : n(Р) : m(Н);
x:y:z:k= 3,03 : 1,514 : 0,757 : 6,82;
x:y:z:k= 4 : 2 : 1 : 9
Значит простейшая формула соединения будет иметь вид O4N2PH9.
Молекулярная формула вещества может содержать удвоенное, утроенное и т.д. число атомов. Чтобы убедиться в том, что молекулярная формула вещества совпадает с простейшей, подсчитаем молярную массу:
Очевидно, что молярная масса для удвоенной формулы будет больше 200, что противоречит условию задачи, следовательно, молекулярная формула вещества O4N2PH9.Перегруппировав атомы легко догадаться, что это вещество является гидрофосфатом аммония (NH4)2HPO4.
Медь (Cu, Cuprum)
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
- орехи, злаки, бобовые
- рыба, морепродукты
- крупы (особенно рис и гречка), макаронные изделия, ржаной хлеб , сырой яичный желток
- кисломолочные продукты , фрукты, ягоды и зелень .
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».