Электрохимическая коррозия: описание процесса и методы борьбы
Тысячелетия развития цивилизации были бы невозможны без металла, из которого изготавливались как наконечники стрел и копий доисторического периода, так и сложнейшие машины современности. Целые эпохи носят «металлические» названия: бронзовый, медный, железный. Металлургические комбинаты работают круглосуточно для обеспечения промышленности необходимым количеством металлических заготовок. Машиностроительные предприятия изготавливают из них огромный ассортимент изделий от труб, рельсов и листов, до иголок и булавок.
Коррозия металлов, особенно ее основная разновидность — электрохимическая, всегда создавала трудности эксплуатации любых металлических изделий, безвременно разрушая их. Простейшие орудия труда (нож, топор, плуг) быстро приходили в негодность во влажной среде. Потребовались многочисленные и длительные исследования химических процессов разрушения, прежде чем были найдены технические решения, приостанавливающие коррозию металлов.
Описание процесса
Электрохимическая коррозия — это процесс, который протекает при обязательном присутствии:
- электролита;
- металлов с низким и высоким окислительно-восстановительными потенциалами (электродные потенциалы).
Электролит образуют вода, конденсат, любые природные осадки. Наличие двух видов металла практически не бывает всегда, и обусловлено двумя факторами:
- Неоднородностью изделия, то есть наличием инородных включений.
- Непосредственным касанием изделий из различных металлов.
В электролите неоднородные металлы образуют короткозамкнутый гальванический элемент, называемый коррозионным. Такое сочетание приводит к растворению металла с более низким электродным потенциалом, что и называют электрохимической коррозией. Скорость этого процесса сильно зависит от наличия солей в растворе и его температуры.
Основные объекты коррозии
Неоднородные металлические участки хаотично расположены на поверхности изделия и зависят от технологии и качества их изготовления, поэтому коррозионные разрушения чаще носят локальный характер. Кроме этого, локальность корродирования зависит от неоднородности:
- защитных оксидных пленок;
- электролита;
- влияния внешних факторов (нагрева, облучения);
- внутренних напряжений, вызывающих неравномерную деформацию.
Сварные и заклепочные соединения являются яркими представителями контакта инородных металлов, подвергающихся активной электрохимической коррозии. Сварка и заклепка — самые распространенные технологии в конструкции неразъемных соединений во всех ведущих отраслях промышленности и крупных трубопроводных системах:
- машиностроение;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводы.
Наиболее значительные разрушения сварных швов и заклепочных соединений возникают в морской воде, присутствие соли в которой, значительно ускоряет процесс коррозии.
Катастрофическая ситуация сложилась в 1967 году с рудовозом «Анатина», когда морская вода от высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней отделке трюмов и стальной корпус способствовали созданию коррозионного элемента в электролите из морской воды. Скоротечная электрохимическая коррозия вызвала размягчение корпуса судна и создание аварийной ситуации, вплоть до эвакуации команды.
Положительный эффект от электрохимической коррозии встречается очень редко. Например, при монтаже новых труб в системах горячего отопления жилых домов. Резьбовые соединения муфт начинают течь при первичном пуске до тех пор, пока продукты коррозии, состоящие из гидратированного железа, не заполнят микропоры в резьбе.
Вне зависимости от вида коррозии, химической или электрохимической, ее последствия одинаковые — разрушение изделий огромной стоимости. Причем помимо прямых потерь от пришедших в негодность материалов, существуют косвенные потери, связанные с утечками продуктов, простоями при замене негодных материалов и деталей, нарушении регламентов технологических процессов.
Современные методы борьбы
Многочисленные исследования и развитие технического прогресса привели к созданию целой системы методов и средств в борьбе с коррозией. Можно отметить три основных направления в защите от коррозии:
- Конструктивные решения.
- Активные методы.
- Пассивные методы.
Конструктивные решения состоят в выборе материалов, которые минимально поддаются коррозии по своим физическим свойствам:
- нержавеющие стали;
- легированные стали;
- цветные металлы.
Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Пассивные методы состоят в нанесении защитных покрытий. Технический прогресс в этой области начал развиваться с нанесения простейших лакокрасочных покрытий, предотвращающих попадания кислорода, влаги и конденсата на поверхность металлов. Затем появились гальванические покрытия на основе:
- цинка — цинкование;
- хрома — хромирование;
- никеля — никелирование.
Оцинкованное железо, никелированные и хромированные столовые приборы, консервные банки с продуктами служат многие годы, не поддаваясь электрохимической коррозии, сохраняя красивый внешний вид, предохраняя порчу продуктов.
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
К уроку №33. Понятие о коррозии металлов. Способы защиты от коррозии
Посмотрите учебный фильм «Коррозия металлов, способы защиты от неё» и ответьте на вопросы:
Что такое «коррозия»?
Какие виды коррозии по механизму протекания можно выделить?
Какие виды защиты от коррозии существуют?
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
1. Коррозия (от латинского «corrodere» разъедать) – самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
2. Виды коррозии : химическая и электрохимическая
I. Химическая – коррозия, обусловленная взаимодействием металлов с веществами, содержащимися в окружающей среде, при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе.
К химической коррозии относятся:
— газовая коррозия — коррозионное разрушение под воздействием газов при высоких температурах;
— коррозия в жидкостях-неэлектролитах.
Газовая
— химическая коррозия, обусловленная взаимодействием металлов с газами.
Основной окислитель – кислород воздуха.
Процессы химической коррозии железа:
3Fe + 3O 2 = FeO·Fe 2 O 3 (смешанный оксид железа (II, III) )
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3 (на воздухе в присутствии влаги)
Химическая коррозия в жидкостях-неэлектролитах
Жидкости-неэлектролиты — это жидкие среды, которые не являются проводниками электричества. К ним относятся: органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин); неорганического происхождения (жидкий бром, расплавленная сера и т.д.). Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется. Например, если нефть будет содержать серу или серосодержащие соединения (сероводород, меркаптаны) процесс химической коррозии ускоряется. Если вдобавок увеличится температура, в жидкости окажется растворенный кислород — химическая коррозия усилится.
Присутствие в жидкостях-неэлектролитах влаги обеспечивает интенсивное протекание коррозии уже по электрохимическому механизму.
Химическая коррозия в жидкостях-неэлектролитах подразделяется на несколько стадий:
— подход окислителя к поверхности металла;
— хемосорбция реагента на поверхности;
— реакция окислителя с металлом (образование оксидной пленки);
— десорбция оксидов с металлом (может отсутствовать);
— диффузия оксидов в неэлектролит (может отсутствовать).
Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.
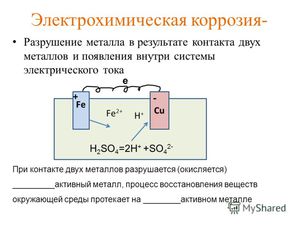
II. Электрохимическая – окислительно-восстановительное разрушение сплавов и металлов, содержащих примеси, с возникновением электрического тока в системе.
АНОД (более активный металл) – разрушается
Ме 0 – nē → Me n+ (процесс окисления)
КАТОД (менее активный металл или примесь неметалла, способного + ē) – восстанавливается среда
кислая среда : 2H + + 2ē → H 2 (процесс восстановления)
влажный воздух : O 2 + 2H 2 O + 4ē → 4OH — (процесс восстановления)
Электрохимическая коррозия железной детали с примесями меди во влажном воздухе.
А: Fe 0 — 2ē → Fe 2+ (Окисление)
К: O 2 + 2H 2 O + 4ē → 4OH — (процесс восстановления)
Итог: 2Fe + O 2 + 2H 2 O = 2Fe(OH) 2 (белая ржавчина)
III. Защита от коррозии:
1). Металлические покрытия – анодное (покрытие более активным металлом Zn, Cr) – оцинкованное железо; катодное (покрытие менее активным металлом Ni, Sn, Ag, Au) – белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия.
2). Неметаллические покрытия – органические (лаки, краски, пластмассы, резина — гумирование, битум);
неорганические (эмали).
3). Протекторная защита – присоединение пластины из более активного металла (Al, Zn, Mg) – защита морских судов.
4). Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5). Добавление ингибиторов ( в зависимости от природы металла – NaNO 2 , Na 3 PO 4 , хромат и бихромат калия, ВМС органические соединения), адсорбируются на поверхности металла и переводят его в пассивное состояние.
Задания и вопросы по теме: «Коррозия металлов и сплавов»
№1. При электрохимической коррозии на поверхности анода протекает процесс
А) Восстановления ионов водорода; Б) Окисления металла;
В) Восстановление молекул кислорода; Г) Окисления молекул водорода.
№2. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
№3. Вот история, произошедшая с норвежским грузовым судном «Анатина». Трюмы теплохода, направлявшегося к берегам Японии, были заполнены медным концентратом. Корпус судна сделан был из стали. Внезапно судно дало течь. Объясните, что произошло.
№4. Какой из компонентов загрязненного городского воздуха является наиболее коррозионно-активным по отношению к металлам, особенно при повышенной влажности:
№5. Рассмотрите рисунок, ответьте на вопросы:
Обратите внимание! В восстановлении кислорода участвуют ионы Н + . Если концентрация Н + понижается (при повышении рН), восстановление О 2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
С усилением коррозии в присутствии солей часто сталкиваются автомобилисты в тех местностях, где в зимнее время для борьбы с гололедицей дороги обильно посыпают солью. Влияние солей объясняется тем, что образуемые ионы создают электролит, необходимый для возникновения замкнутой электрической цепи.
X Международная студенческая научная конференция Студенческий научный форум — 2018
Примером электрохимической коррозии является разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. При электрохимической коррозии всегда требуется наличие электролита (конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами.
Коррозионный элемент
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани
В гальванических элементах происходит переход химической энергии в электрическую энергию
Гальванический элемент содержит два металлических электрода, которые отличаются значениями своих электродных потенциалов. Электроды соединены между собою проводником и погружены в раствор электролита. Более активный металл является анодом, на котором протекает окисление, а менее активный – катодом, на котором протекает восстановление. Электроны, которые освобождаются при окислении анода, перемещаются на катод. Благодаря пространственному разделению полуреакций окисления и восстановления возникает электрический ток.
Анодом (А) называется участок поверхности металла, с которого ионы переходят в раствор электролита. Анод заряжен отрицательно (-) и на нем протекает окислительный процесс разрушения металла. Катод (К) — участок поверхности металла, где разряжаются катионы электролита. Катод заряжен положительно (+) и на нем протекает восстановительный процесс. Таким образом, поверхность металлического изделия представляет собой совокупность катодных и анодных микроучастков, которые в среде электролита образуют короткозамкнутые гальванические элементы. Во время работы гальванические элементы могут частично поляризоваться. В результате перехода электронов с анода на катод потенциал катода становится более отрицательным, а потенциал анода более положительным. В этом случае происходит явление выравнивания потенциалов, что вызывает прекращение тока и коррозии.
Активность металла характеризуется величиной стандартного потенциала металла. Чем меньше величина стандартного потенциала металла, тем больше способность атомов металла, погруженного в раствор, отдавать электроны, т.е. тем больше его химическая активность. В зависимости от величины стандартного потенциала металлы объединены в электрохимический ряд напряжений. Окислительная способность металлов увеличивается в этом ряду слева направо, а восстановительная способность металлов увеличивается справа налево. Чем левее находится металл в ряду напряжений (чем отрицательней значение его потенциала), тем выше его химическая активность. Анодом является более химически активный металл в паре, а катодом — пассивный.
Причины возникновения местных гальванических элементов:
1) неоднородность сплава
• неоднородность металлической фазы, обусловлена неоднородностью сплава и наличием микро- и макровключений;
• неравномерность окисных пленок на поверхности за счет наличия макро-и микропор, а также неравномерного образования вторичных продуктов коррозии;
• наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
• область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
• облучение (облученный участок — анод);
• воздействие внешних токов (место входа блуждающего тока — катод, место выхода — анод);
• температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
Анодные и катодные процессы при электрохимической коррозии металлов
Любой металл содержит примеси других металлов, поэтому в среде электролита система из основного металла (Мe1) и металла-примеси (Мe2) образуют большое число микрогальванических элементов:
где более активный металл, например Мe1, является анодом (А) и на аноде идут процессы окисления (окисляется сам металл):
Менее активный металл (Мe2) является катодом (К), на катоде идет процесс восстановления окислителя среды. При электрохимической коррозии в кислой среде на поверхности катода (менее активного металла) происходит восстановление катионов водорода:
процесс электрохимической коррозии Cu–Zn в кислой среде:
Zn + 2H + = Zn 2+ + H2
Образование гальванической пары Cu–Zn ускоряет процесс разрушения цинка.
Катионы водорода, восстанавливаясь на катоде, принимают электроны на медной поверхности, а на аноде происходит окисление цинка. Таким образом, при электрохимической коррозии происходит возникновение электрического тока, обусловленное перемещением электронов по поверхности металлов.
Морская вода имеет слабощелочную реакцию среды, рН варьирует в пределах от 7,5 до 8,4. При электрохимической коррозии в щелочной среде на аноде происходит окисление (разрушение) металла, а на катоде – восстановление молекулярного кислорода, растворенного в морской воде. А: Me(0) – ne → Me(n+) К: 2H2O + О2 + 4e → 4OH(-) (рН ≥ 7 – среда слабощелочная) При электрохимической коррозии анодом становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала.
Влажная атмосферная коррозия наблюдается при наличии на поверхности тончайшей пленки влаги. Толщина такой пленки составляет от 100 до 1 мкм. Относительная влажность воздуха, при которой начинается образование влажной пленки, составляет около 60 – 70%. Значение, при котором начинается конденсация на поверхности влаги, называется критической влажностью. Критическая влажность зависит от загрязнения воздуха и состояния металла.
Уравнение атмосферной коррозии:
Анод: ионы металла переходят в раствор:
Катод: проходит реакция восстановления:
O2 + 2H2O + 4e → 4OH — (щелочные, нейтральные среды)
O2 + 4H + + 4e → 2H2O (подкисленная среда)
Во многом стойкость металлов и сплавов, в условиях атмосферной коррозии, зависит от природы металла и состояния его поверхности.
Термодинамические основы процессов коррозии
Термодинамическую возможность электрохимической коррозии, как любого химического процесса, можно определить по изменению энергии Гиббса. Поскольку коррозия является самопроизвольно протекающим процессом, то сопровождается ее убылью, т.е. ∆GT Me + mHO +ne.
Анодная пассивность металлов.
При значительном торможении анодной реакции ионизации металла скорость коррозионного процесса может понизится на несколько порядков. Такое состояние металла принято называть анодной пассивностью. Пассивность можно определить следующим образом: пассивность — состояние повышенной коррозионной устойчивости металла или сплава (в условиях, когда термодинамически он является реакционно способным), вызванное преимущественным торможением анодного процесса. Т.е. может произойти так, что в реальных условиях скорость коррозии «активных» элементов оказывается весьма незначительной в следствии наступления пассивного состояния. Например, титан расположенный левее цинка, и хром, расположенный рядом с цинком, в следствии наступления пассивности оказываются более коррозионностойкими в большинстве водных сред, чем цинк.
На склонность к пассивному состоянию влияет природа системы металл-раствор. Наибольшую склонность к переходу в пассивное состояние проявляют Ti,Ni,Al,Mg,Fe,Co и др.
Экспериментальное изучение процесса коррозии.
При выполнении практической части работы был проведен ряд экспериментов.
Опыт 1. Изучение влияния среды на коррозию железа
Посуда и реактивы: четыре химические пробирки, четыре железных гвоздя; дистиллированная вода, 0.5н раствор хлорида натрия, 0.5н раствор гидроксида натрия, 0.5 н раствор хлорида аммония.
Четыре одинаковых железных гвоздя помещают в четыре пробирки, приливают разные жидкости, закрывают пробирки и в течение месяца наблюдают за происходящими изменениями. В пробирке № 1 дистиллированная вода (вода была оставлена на воздухе для на насыщения O2 ); в пробирке № 2 раствор хлорида натрия, в пробирке № 3 раствор гидроксида натрия, в пробирке № 4 раствор хлорида аммония.
Коррозия железа наблюдается во всех пробирках, кроме третьей.
Рис.1. Первая неделя эксперимента.
Рис.2.Вторая неделя эксперимента.
Рис.3. Третья неделя эксперимента.
Рис.4. Четвертая неделя эксперимента.
В пробирке 1 мало ржавчины, в чистой воде коррозия идет медленно т. к. вода слабый электролит.
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
В пробирке 2 ржавчины больше, следовательно, хлорид ионы увеличивают скорость коррозии. Эта система аналогична морской воде. Роль катода выполняют примеси в железе.
А: Fe 0 — 2e — →Fe 2+
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
В пробирке 3 ржавчины не наблюдается. В щелочных растворах (рН ≥ 10) на железе происходит образование нерастворимых гидроксидов, и скорость коррозии резко падает.
В пробирке 4 ржавчины много.
Это объясняется тем, что железо неустойчиво в кислой среде. Кислая среда обеспечивается солью NH4Cl. Соль образована слабым основанием и сильной кислотой (гидролиз протекает по катиону). (NH4ОH -слабое основание, НСl — сильная кислота).
NH4 + + НОН ↔ NH4OH + Н + сокращенное уравнение
NH4Cl + Н2О ↔ NH4OH + НСl молекулярное уравнение
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н + накапливаются в растворе и cреда становится кислой pH катодное покрытие
Реакции в кислой среде:
А: Fe 0 -2e — →Fe 2+
При нарушении целостности катодного покрытия разрушается защищаемый металл (Fe).
Zn более активный металл, чем Fe => анодное покрытие
Реакции в кислой среде:
А: Zn 0 -2e — →Zn 2+
При нарушении целостности анодного покрытия разрушается покрытие, а металл (Fe) остается защищенным.