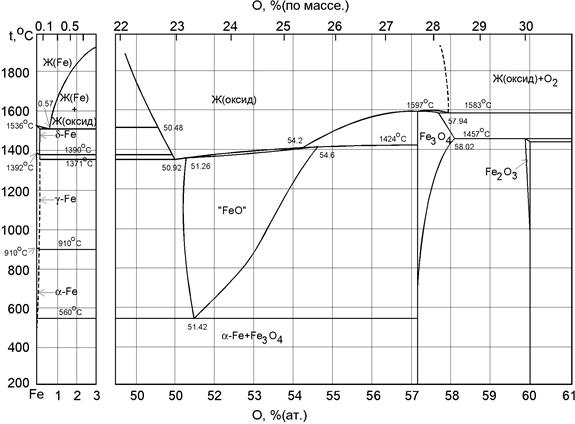
Диаграмма состояния железо-кислород
В системе установлено существование трех промежуточных фаз: вюстита (близко к FeO), магнетита (Fe3O4) и гематита (Fe2O3).
Вюстит — соединение переменного состава, близкого к FeO, устойчиво при избытке кислорода. Вюстит образуется при 1430. 1435 °С по перитектической реакции ж+ Fe3O4↔вюстит. Область гомогенности этой фазы определена и подробно описана в [А-В]. По данным электрохимических измерений , границы области гомогенности вюстита при различных температурах:
| t, °C | 1000 | 900 | 800 | 700 | 650 | 600 | 570 |
| О, %(ат.) | 51,13 | 51,18 | 51,25 | 51,34 | 51,36 | 51,43 | 51,60 |
| 52,89 | 52,69 | 52,52 | 52,44 | 52,30 | 51,84 |
Распадается вюстит по эвтектоидной реакции: вюстит↔а-Fe+Fe3O4 при 560°С; эвтектоидная точка расположена при 51,41 % (ат.) О. Решетка вюстита типа NaCl. С увеличением содержания кислорода период решетки уменьшается почти линейно; Ниже — 70°C кубическая решетка превращается в ромбоэдрическую.
| Диаграмма состояния железо-кислород Fe-O |
Магнетит Fe3O4 [57,15 % (ат.) О] плавится с открытым максимумом при
1600 °С. В сплавах, более богатых кислородом, при 1583 °С протекает реакция ж↔ Fe3O4 + О2. В равновесии с кислородом магнетит находится до 1457 °С. Он имеет решетки типа шпинели с периодом а = 0,8397 нм.
Гематит Fe2O3 образуется по реакции Fe3O4+O2 ↔ Fe2O3 при 1457 °С. Он существует в двух формах: стабильной a-Fe2O3 и метастабильной у-Fe2O3. Структура a-Fe2O3 — ромбоэдрическая типа корунда с a = 0,54271 нм и α = 55° 15,8′. Ее также интерпретируют как гексагональную с 30 атомами в элементарной ячейке и периодами а = 0,50345 нм, с = 1,3749 нм, с/а = 02,737. у-Fe2O3 обладает решеткой типа шпинели с периодом а = 0,834 нм. Имеются указания и на более сложную структуру- тетрагональную сверхструктуру с периодом решетки а = 0,833 нм, С = 2,499 нм .
В богатых железом сплавах при высоких температурах наблюдается область несмешиваемости; температура монотектики 1523 °С; монотектическая точка 0,56 % (ат.) О. При повышении температуры растворимость кислорода в жидком железе увеличивается и при 1700 °С составляет 1,10 % (ат.). При монотектической температуре, по данным различных исследований, растворимость кислорода в δ-Fe составляет 0,02. 0,21 % (ат). В y-Fe при 1345 °С растворяется 0,01 ± 0,01 % (ат.) О, а при 950 °С <0,02 % (ат.) О. В a-Fe растворимость кислорода не превышает 0,1 % (ат.). Растворимость кислорода в деформированном железе более, чем на порядок, превышает его растворимость в литом.
Основные бинарные и тройные диаграммы состояния систем, являющиеся основой расплавов пирометаллургических процессов. Применение диаграмм состояния для анализа пирометаллургических процессов
Рассмотрим вид и основные характеристики важнейших для цветной металлургии реальных систем: Fe-O, Cu-O, Fe-S и др., которые составляют основу многих руд, шлаковых и штейновых расплавов.
Фазовые диаграммы Me-O
Система Fe-O
Эта система является важнейшей, как для черной, так и для цветной металлургии. Именно поэтому ей посвящено наибольшее количество исследований, касающихся как фазового состава, так и свойств твердых фаз и расплавов.
T-X диаграмма, построенная по данным Даркена и Гурри, в настоящее время представляется наиболее надежной (рисунок 3.6).
Рисунок 3.6. Диаграмма Fe-O
Известны следующие модификации железа в твердом состоянии: α-Fe (устойчиво до 1041 К), β-Fe (1185-1667 K) и δ-Fe (1667-1811 K). При 1042 К железо претерпевает магнитное превращение (точка Кюри).
Поскольку, как отмечалось выше, абсолютно чистых веществ в системе Me-X не существует, то вблизи оси ординат диаграммы Fe-O существует область твердых растворов, увеличивающаяся с повышением температуры, однако, максимальная предельная растворимость кислорода не превышает сотых долей процента.
В системе железо-кислород известны три оксида: гематит Fe2O3, магнетит Fe3O4 и вюстит Fe1-XO. Все они, а особенно вюстит, обладают значительной областью гомогенности.
Стабильность ограничена пределом температуры в 843 К, ниже которой вюстит разлагается на металлическое железо и магнетит:
Избыточное содержание кислорода в вюстите по отношению к стехиометрии незначительно изменяется с ростом температуры от 973 до 1673 К на границе Fe- Fe1-XO (1,057 до 1,053) и несколько больше на границе Fe1-XO- Fe3O4 (1,094-1,197).
Содержание кислорода при 16673 К в гомогенном твердом вюстите возрастает от 23,18 до 25,54 % (по массе).
Второе химическое соединение – магнетит, до 1073 К имеет очень узкую область гомогенности. Выше этой температуры область гомогенности расширяется. Причем, левая сторона области гомогенности практически точно совпадает с составом стехиометрического Fe3O4. Справа о этой области состав магнетита выше 1073 К можно представить формулой Fe3-XO4.
Значительно меньше данных о фазовом состоянии гематита, особенно в области высоких температур. Можно с определенной уверенностью говорить о том, что правая сторона области гомогенности гематита вплоть до высоких температур близка по составу к стехиометрии Fe2O3. Левая сторона как будто бы имеет отклонение влево. О причине разупорядоченности в структуре гематита достаточно надежные сведения отсутствуют. При комнатных температурах область гомогенности гематита, по-видимому, невелика и для технологических расчетов металлургических процессов его состав можно принять близким к стехиометрическому — Fe2O3.
На фазовой диаграмме Fe-O имеется ряд одно- и двухфазных областей, где в равновесии находятся конденсированные фазы и газ с определенной концентрацией кислорода. К однофазным системам относятся: Fe-вюстит, вюстит- магнетит, железо-магнетит, расплав-конденсированные фазы, магнетит-гематит.
Система Cu-O
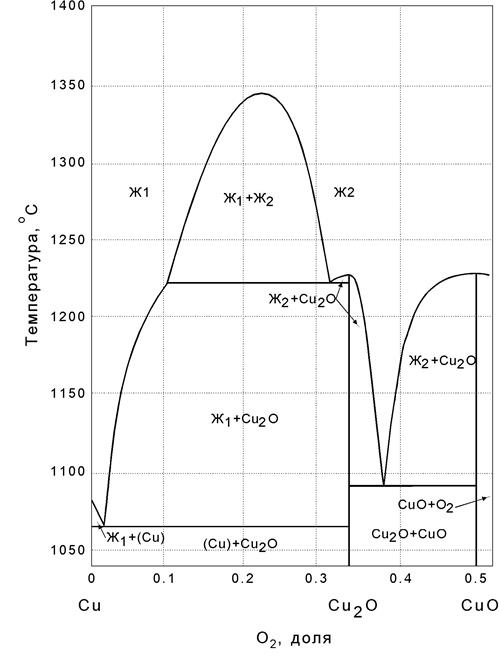
В системе Cu-O образуется два химических соединения Cu2-XO, которому отвечает природный минерал куприт, и оксид меди CuO (природный минерал тенорит) (рисунок 3.7.). Так же как и вюстит Cu2-XO может существовать в определенном температурном интервале (375-1200 °С, При охлаждении ниже температуры 375 °С протекает реакция дисропорционирования:
При этом образуется медь, насыщенная кислородом, и оксид меди, отвечающий по составу медному краю области гомогенности. Монооксид меди сравнительно малоустойчивое вещество, хотя и плавится без разложения. Область его существования в жидком виде сравнительно невелика.
Монооксид меди и металлическая медь ограниченно растворимы друг в друге. Область расслаивания занимает значительную часть диаграммы.
Эвтектика медь – монооксид меди содержит 1,85 % O и имеет температуру плавления 1065 °С .
Оксид меди соединение неустойчивое. Оно полностью разлагается на воздухе при 1122 °С, т.е. горизонталь 1120 отвечает нонвариантному равновесию следующих фаз: CuOтв., жидкость, содержащая 14 % O, и газовая фаза. Области устойчивости различных фаз в зависимости от PO2 и T приведены на рисунке 3.7. В связи с малым масштабом области гомогенности показаны одной линией. Однако это не свидетельствует об отсутствии областей переменного состава. В частности, для Cu2-XO так же, как и для Fe1-XO, наиболее характерными дефектами являются вакансии в подрешетке меди, а область гомогенности следует рассматривать как раствор вакансий меди в решетке Cu2-XO.
Рисунок 3.7. Диаграмма Cu-O
Фазовые диаграммы Me-S
Сульфидные руды являются основным сырьем металлургии тяжелых цветных металлов. Нередко они содержат большое количество сульфидов железа. В процессе пирометаллургической переработки концентратов довольно часто в качестве промежуточного продукта получают штейны – сплав сульфидов железа и цветных металлов. Поэтому для сознательного управления технологическим процессом металлургу необходимо знать важнейшие фазовые диаграммы сульфидных систем.
Система Fe-S
На рисунке 3.8 представлена T-X- проекция диаграммы Fe-S
Рисунок 3.8 Диаграмма Fe-S
В системе железо-сера существует одно устойчивое химическое соединение — пирротин (Fe1-xS) с широкой областью гомогенности, и одно неустойчивое – пирит FeS2, у которого область гомогенности невелика.
Формула сульфида железа Fe1-xS, откуда можно сделать вывод, что в кристаллической решетке атомов железа меньше, чем серы, на величину x, т.е. концентрация вакансий железа равна x. Кристаллы, составы которых отвечают железному краю области гомогенности, близки к стехиометрическим — отношение железа к сере в них 1. На серном крае области гомогенности содержание серы при температуре 743 (по другим данным 745) °С достигает 54,5 % (ат.). Следовательно, почти 10 % узлов железа оказываются незаполненными.
Согласно правилу фаз, каждой точке внутри области пирротина соответствует строго определенное равновесное давление серы. Возьмем, например, точку E. Задав точку на диаграмме состояния мы тем самым определим состав и температуру. Из правила фаз следует, что в области 1 число степеней равно 2. Но для точки E характерны определенные состав твердой фазы и температура, следовательно, эти две степени свободы использованы, поэтому над системой должно быть строго определенное давление серы. Произвольное изменение давления поведет к перемещению положения точки, определяющей состояние системы, т.е. к нарушению равновесия, в результате чего начнет протекать химическая реакция.
Показать области с одной степенью свободы (нонвариантные), в которых каждой температуре отвечает строго постоянный состав фаз и равновесное давление серы. При перемещении по изотерме фигуративной точки, определяющей состав системы, не меняются ни состав, ни число находящихся в равновесии фаз, ни равновесное давление. Изменяется лишь количественное отношение фаз, которое легко может быть рассчитано по правилу рычага.
Горизонталь 745 °С соответствует нонвариантному равновесию Fe1-xS (показать состав), пирита (показать состав), жидкости и пара. Изменение одного из независимых параметров поведет к исчезновению одной из конденсированных фаз. Например, нагревание системы, отвечающей составу новариантного равновесия, приведет к исчезновению пирита и образованию пирротина серного края его области гомогенности. Охлаждение системы – к исчезновению жидкости. При незначительном уменьшении давления серы против равновесного полностью исчезают жидкость и пирит.
Приведенными примерами продемонстрировано, какую ценную информацию могут дать диаграммы состояния для суждения о возможных процессах и составе получающихся фаз. Мало того, не зная диаграммы состояния далеко не всегда можно предсказать, какой процесс будет протекать в тех или иных условиях и каков будет состав конечных продуктов. Допустим, что необходимо сульфидированием пирротина получить пирит. Допустим также, что экспериментатор решил проводить этот процесс при 750 °С. Достаточно взглянуть на диаграмму, чтобы убедиться, что этих условиях получить пирит принципиально невозможно. Повышение давления пара серы над пирротином приведет лишь к тому, что весь материал перейдет в жидкое состояние. Получение пирита следует проводить при температуре <745 °С. При этом достаточно небольшого повышения давления серы, чтобы после необходимой выдержки весь пирротин перешел в пирит. Это простейший пример. Более трудные случаи могут встретиться при рассмотрении процессов окисления или восстановления в системах, в которых образуется целый ряд соединений.
Кроме фазовых превращений, на которых мы остановились достаточно подробно, диаграмма состояния дает ценную информацию о температурах плавления. В частности, для системы железо-сера температура плавления пирротина составляет по данным ряда исследований 1200 °С. Температура плавления эвтектики со стороны железа 983 °С. Это говорит о том, что сульфиды относительно легкоплавкие соединения.
Экспериментальные данные, полученные рядом авторов показывают, что давление паров серы (кислорода) над сульфидами (оксидами) резко возрастают в зависимости от их состава. Например, при температуре 900 °С равновесное давление серы над пирротином для граничных составов отличается в 10 9 раз
Составы минералов (пирита, халькопирита, сфалерита и др.), взятые из разных месторождений или участков одного и того же месторождения, будут отличаться по составу и свойствам. Недооценка этого различия может приводить к серьезным ошибкам в расчетах и в выборе технологических режимов, поскольку даже незначительные изменения в составах (0,01; 0,001 %) могут резко сказываться на флотируемости, растворимости и других технологических свойствах минералов.
Система Cu-S
В системе медь-сера (рисунок 3.9) также имеются два химических соединения: высший CuS и низший Cu2S сульфиды.
Рисунок 3.9. T-X проекция фазовой диаграммы Cu-S (а) и равновесное давление серы (б)
Высший сульфид меди – ковеллин относится к неустойчивым химическим соединениям. При температуре 507 °С он полностью разлагается, при 120 °С претерпевает полиморфное превращение.
Низший сульфид меди образует довольно широкую область гомогенности. Значение x в формуле соединения Cu2-xS.
Диссоциация оксидов железа с учетом существования растворов
На диаграмме состояния (рис. 7). только высший оксид (гематит) представлен вертикалью, характерной для соединений постоянного состава. Оксиды и FeO имеют области гомогенности, то есть являются соединениями переменного состава. Эти фазы называются магнетитом и вюститом. Они имеют повышенное по сравнению со стехиометрией оксидов содержание кислорода.
С термодинамической точки зрения нестехиометричность оксидов и можно трактовать как образование твердых растворов в и в . Условия существования (состав–температура) только этих гомогенных растворов и в гетерогенной смеси их с другими фазами соответствуют определенным областям ненасыщенных растворов (IX и XV) и областям X, XII, XII, XIII, XVII насыщенных растворов на диаграмме состояния (см. рис. 7).
В упрощенной записи (без указаний на изменения состава фаз) схемы превращений могут быть представлены в виде:
Эти схемы соответствуют общему принципу последовательности превращений А.А. Байкова от высшего оксида к металлу через все устойчивые более низшие оксиды.
Согласно этим упрощенным схемам уравнения реакций диссоциации часто записывают как взаимодействия стехиометрических соединений (постоянного состава)
Более строго, с учетом растворимости оксидов и образования растворов кислорода в твердом Fe (область I), уравнения реакций диссоциации можно записать в виде:
| (область XVII) | (27) |
| (область XV) | (28) |
| (область XII) | (29) |
| (область IX) | (30) |
| (область X) | (31) |
| (область XIII) | (32) |
Рис. 7. Диаграмма состояния системы железо–кислород:
А – 1808 К, 0% IX – вюстит FeO1+x
Е – 1643 К, 23,16% (
H – 1697 К, 25,60% (
К – 1870 К, 27,64% (Fe3O4) XIV – Fe3O4+y + оксидный расплав
M– 1730 К, 28,36% (
I – условная область твердых растворов XVII – Fe3O4+y + Fe2O3
кислорода в d, g и a-железе XVIII – гематит Fe2O3 + O2
II – растворы кислорода в жидком Fe
III – Feж(O) + оксидный расплав
IV – оксидный расплав
V – оксидный расплав + О2
VI – Fed(O) + оксидный расплав
VII – Feg(O) + оксидный расплав
VIII – вюстит + оксидный расплав
В уравнениях (2.27), (2.29), (2.31) и (2.32) оксиды записаны как фазы (насыщенные растворы); в уравнениях (2.28) и (2.30) оксиды рассматриваются как компоненты ненасыщенных растворов магнетита и вюстита.
Для анализа равновесий в системе на диаграмму состояния нанесены вспомогательные линии при 3 температурах 773, 1273 и
1600 К и отмечены точки фазовых превращений (а, b, и т.д.).
Рассмотрим систему, описываемую уравнением (10). Константа равновесия реакции равна
Аналогично можно проанализировать равновесия (27) и (32) и, дополнив анализ теоретическим положением об уменьшении равновесного давления кислорода над раствором кислорода в Fe по мере перехода к чистому железу, построить изотермы упругости диссоциации оксидов железа (рис. 8).
Рис. 8. Изотермы упругости диссоциации оксидов железа
На рис. 8 линии наклонных участков проведены приближенно, так как для точного построения необходимы расчеты на основе данных об активностях компонентов растворов. Точки перелома взяты с диаграммы состояния системы Fe – O. Значения упругости диссоциации оксидов в моновариантных системах соответствуют расчетным величинам рис.4.
Таким образом, изотерма упругости диссоциации последовательно распадающихся и образующих растворы соединений состоит из чередующихся горизонтальных и наклонных участков.
По мере диссоциации, в конечном счете, идет упрочнение фаз. Для получения чистого металла необходимо полностью удалять из газовой фазы кислород.
Метастабильная диаграмма состояния железо-углерод
– это графическое отображение структуры сплавов, состоящих только из железа и углерода, в зависимости от исходной средней концентрации углерода и текущей температуры сплава. Диаграмма железо-углерод позволяет понять процессы, происходящие при
термообработке стали
.

Диаграмма железо-углерод (железо-цементит). Упрощенная
Структуры на диаграмме железо-углерод
Напомним о 2 кристаллических формах железа:
- α-железо
. Имеет объемноцентрированную кубическую (
ОЦК
) решетку; - γ-железо
. Имеет гранецентрированную кубическую (
ГЦК
) решетку.

Кристаллическая решетка железа
Полиморфное превращение одной формы в другую при проведении термообработки сталей
происходит при прохождении сплавами линии GSK.
Выделим 4 фазы в системе железо-углерод:
- Жидкая фаза. Концентрация углерода не ограничена;
- Феррит
– это твёрдый раствор углерода в α-железе. Максимальная концентрация углерода – всего лишь 0,025% (точка P). При комнатной температуре – не выше 0,006%. Феррит мягок и пластичен. - Аустенит
– твёрдый раствор углерода в γ-железе. Максимальная концентрация углерода — 2,14 % (точка E). Аустенит имеет невысокую твёрдость, пластичен, не магнитится. - Цементит
— химическое соединение железа с углеродом (карбид железа, Fe3C). Концентрация углерода, соответственно, постоянная – 6,67 % углерода. Цементит очень твёрд, хрупок, непластичен.
В зависимости от условий образования выделяют:
- первичный цементит (образуется из жидкости);
- вторичный цементит (выделяется из аустенита вокруг его зерен);
- третичный цементит (выделяется из феррита по границам его зерен);
- эвтектоидный цементит (является составной частью перлита);
- эвтектический цементит (является составной частью ледебурита).
Необходимо так же выделить 2 структурные составляющие железоуглеродистых сплавов:
- Перлит
(
эвтектоид
) – механическая смесь 2 фаз – пластинок/зерен феррита и цементита. Перлит образуется в результате перлитного превращения аустенита («свободного» или входящего в состав ледебурита) с концентрацией углерода 0,8% при прохождении ниже линии PSK:
Структура перлита. Ф — феррит, Ц — цементит
Железо при этом переходит из γ-формы в α-форму. Механические свойства сильно зависят от размера (дисперсности) частичек, из которых состоит данный перлит.
- Ледебурит
(
эвтектика
) – механическая смесь 2 фаз – пластинок/зерен аустенита и цементита. Ледебурит образуется из жидкой фазы с концентрацией углерода 4,3% при прохождении ниже линии ECF:
Структура ледебурита. Ц — цементит, А — аустенит.
Повторяясь, напомним, что при прохождении сплавов ниже линии PSK (727°С) аустенит, входящий в состав ледебурита, претерпевает перлитное превращение, разделяясь на феррит и цементит. Ледебурит тверд и хрупок.
При комнатной температуре железоуглеродистые сплавы могут иметь различную структуру, а значит и свойства, хотя и состоят всегда всего из 2 фаз: феррита и цементита.
Химические свойства
Как химическое соединение цементит обладает своими физическими, химическими и механическими характеристиками. Он имеет серый кристаллический вид на изломе, относительно твёрдый с высокой термической устойчивостью. Основные химические свойства цементита выражаются в следующих показателях:
- химическая формула Fe3C;
- разложение структуры происходит при температуре более 1650°С;
- подвержен воздействию различных кислот (особенно высоко концентрированных);
- быстро вступает в реакцию с кислородом.
На основании существующих химических свойств сформированы физические и механические свойства. К основным физическим свойствам относятся:
- температура плавления равняется 1700 °С;
- молекулярная масса составляет 179,55 а.е.м.;
- плотность цементита равна 7,7 г/см3 при температуре равной 20 °С.
К основным механическим свойствам относятся:
- твердость;
- стойкость к ударным воздействиям (хрупкость);
- сопротивление на излом;
- пластичность.
Твёрдость этого соединения достигает больших значений и равна НВ 8000 МПа или HRC 70. Однако он обладает достаточной хрупкостью и низкой пластичностью.
Обладая перечисленными свойствами, цементит активно используется при производстве литых деталей различного назначения. Образование различного вида цементита и его соединений с другими формами приводит к изменению характеристик получаемой стали или чугуна, следовательно, к улучшению или снижению отдельных потребительских свойств.
Например, для получения белого чугуна и придания ему высокой прочности и пластичности стараются перевести цементит в графит. Это достигается при проведении операции отжига. При возрастании температуры он распадается на две составляющие: феррит и графит.
Иногда вместо феррита в чугуне образуется перлит. В этих случаях получается две формы чугуна. Первая называется ферритным, вторая – перлитным.
В зависимости от требуемых свойств в чугуне стараются сохранить требуемое количество цементита. Особенно это касается так называемого свободной фракции этого соединения. Для снижения его концентрации применяют различные способы химической и термической обработки. Для решения этой задачи применяют раствор азотной кислоты в чистом спирте. Структурно свободный цементит выпадает в осадок в результате кипячения чугунной болванки в этом растворе. Кроме этого применяют три вида обработки: отжиг, нормализацию и закалку.
Техническое железо содержит третичный цементит в сочетании с ферритом. Он проявляется по границе феррита при содержании углерода от 0,01% до 0,025%. Для повышения качества стали стараются снизить содержание свободного цементита. Особенно его концентрация наблюдается в мягких марках стали. Большое влияние на качество штамповки оказывает содержание этой смеси и перлита в единице объёма. Излишнее присутствие третичного цементита, особенно в форме продолжительной цепочки или сетки приводит к образованию разрывов во время штамповки. Поэтому для получения хорошей ковочной стали стараются снизить количество третичного цементита. Структура таких образований не должна превышать второго балла по установленной шкале. Получаемая твёрдость не должна превышать HB 50 единиц.
Некоторые элементы диаграммы железо-углерод
Выделим несколько границ на диаграмме железо-углерод:
- линия ACD. Линия ликвидус
. При охлаждении сплавов ниже нее начинается их кристаллизация; - линия AECF. Линия солидус
. При охлаждении сплавов ниже нее весь сплав переходит в твердое состояние; - линия ECF. Иногда называется линией ледебуритного превращения. При охлаждении сплавов с содержанием углерода выше 2,14% ниже нее жидкая фаза превращается в ледебурит;
- линия PSK. Линия перлитного превращения
. При охлаждении сплавов ниже нее аустенит превращается в перлит.
Отметим несколько важных точек на диаграмме:
- точка E. Точка максимального насыщения аустенита углеродом – 2,14%, при температуре 1147°С;
- точка P. Точка максимального насыщения феррита углеродом – 0,025%, при температуре 727°С;
- точка S. Точка «0,8% С-727°С» превращения аустенита с концентрацией углерода 0,8% в перлит (эвтектоид) той же средней концентрации;
- точка C. Точка «2,14 % С-1147°С» превращения жидкости с концентрацией углерода 2,14% в ледебурит (эвтектику) той же средней концентрации.
Часто значения температур, при которых происходят структурные изменения конкретного сплава обозначают буквами A:
- A1 – линия PSK;
- A2 – линия MO – точка Кюри, в которой происходит изменение магнитных свойств сплавов;
- A3 – температуры, соответствующие линии GS;
- Acm – температуры, соответствующие линии SE.
Поскольку температуры фазовых переходов при нагреве и охлаждении слегка отличаются, то часто вводят дополнительные буквенные обозначения:
- с – для температур фазовых переходов при нагреве;
- r – при охлаждении,
например, Ac1 или Ar1.
Диаграмма состояния – фундамент понимания сталей
Изучение микроструктуры всех сталей обычно начинают с рассмотрения метастабильной диаграммы состояния железо-углерод (Fe-C) (рисунок). Ее также называют диаграммой состояния железо-цементит (железо-карбид железа). Эта диаграмма дает фундамент для понимания структуры и фазового состава как углеродистых, так и легированных сталей, а также различных термических обработок, которым они подвергаются. См., например, “работу” диаграммы состояния или, может быть, правильнее фазовой диаграммы, при кристаллизации стали в статье “Литая структура стали“.
Рисунок – Метастабильная диаграмма состояния показывает какие фазы можно ожидать в стали при различных комбинациях содержания углерода и температуры. Иногда ее называют диаграммой состояния железо-цементит.
Чтение диаграммы железо-углерод
Состав сплава с данным исходным содержанием углерода при заданной температуре мы можем увидеть, двигаясь по вертикальной линии, соответствующей содержанию углерода в сплаве.
Рассмотрим, например, область AEC. С ней соседствуют области аустенита AESG и жидкой фазы. Сплавы в ней состоят из жидкой фазы и образующегося твердого аустенита. Как определить концентрацию углерода в разных фазах для данного сплава? Рассмотрим для примера сплав с исходной концентрацией углерода 2,5% при температуре 1250°С.
Проведем из этой точки графика «2,5% C – 1250°С» горизонтальную прямую. Пересечение этой прямой с линией AE, граничащей с областью аустенита, покажет концентрацию углерода в аустените при данной температуре (
Пересечение этой же горизонтальной прямой с линией AС, граничащей с областью жидкой фазы, покажет концентрацию углерода в жидкой фазе при данной температуре (
Именно таким образом мы можем определить концентрацию углерода в фазах любого сплава при заданной температуре:
- в жидкой фазе и аустените в области AEC;
- в жидкой фазе в области CDF (концентрация углерода в цементите, конечно, постоянна – 6,67%);
- в аустените в области SEFK;
- в феррите в области QPKL;
- в феррите и аустените в области GPS.
Как видим, при концентрации углерода выше 2,14% насыщение охлаждаемого расплава углеродом всегда стремится к 4,3% (по линиям AC и DC) по мере приближения к температуре 1147°С (уровень ECF). Далее происходит превращение жидкости в ледебурит (эвтектику). Естественно, с этим же средним содержанием углерода.
По мере приближения к температуре 727°С (уровень PSK) концентрация углерода в аустените («свободном» и/или входящем в состав ледебурита) стремится к 0,8% (по линиям GS и ES). Далее происходит превращение аустенита в перлит (эвтектоид). Перлит, конечно, имеет среднее содержанием углерода 0,8%.
Эвтектоидный перлит
Содержание углерода, при котором аустенит имеет минимальную температуру, называется эвтектоидным содержанием (0,77 % углерода по массе для случая метастабильной диаграммы состояния). Смесь ферритной и цементитной фаз при этом составе углерода, которая образуется при медленном охлаждении имеет характерную пластинчатую структуру, которую называют перлитом. Перлит представляет собой совокупность чередующихся пластин феррита и цементита. Эти пластины после выдержки при температуре близкой к А1 огрубляются («сфероидизируются») в цементитные частицы, распределенные в ферритной матрице.
Классификация железоуглеродистых сплавов
Классификация железоуглеродистых сплавов в зависимости от концентрации углерода в сплаве:
- C<0,025%. Техническое железо
. При комнатной температуре будет состоять только из феррита; - 0,025Стали
:
- 0,025
- C=0,8. Эвтектоидная сталь. «Чистый» перлит;
- 0,8
- 2,14Чугуны
:
- 2,14
- C=4,3. Эвтектический чугун. «Чистый» ледебурит;
- 4,3
Техническое железо выделяет то, что оно состоит исключительно из феррита. Который и определяет его свойства: мягкость, чрезвычайную пластичность и т.д.
Чугуны же выделяет наличие ледебурита, придающего им хрупкость. Поэтому чугуны не могут подвергаться ковке. Зато обладают лучшими литейными свойствами (чем стали), обусловленными наличием легкоплавкого ледебурита.
Термообработка сталей в ООО КВАДРО
Наше предприятие уже почти четверть века производит на заказ термообработку металлов в Санкт-Петербурге.
Мы производим термообработку сталей (в т.ч. нержавеющих, инструментальных и т.п.) по чертежам Заказчика или заданным режимам, а так же иных металлов и сплавов (алюминиевых и титановых, латуней и бронз, и т.д.).
Основные виды термической обработки металлов, осуществляемые на нашем предприятии на заказ: