Структурная и молекулярная формула
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена в лаборатории достаточно на карбид кальция (это его формула — СаС2) капнуть небольшое количество воды. после этого начинается бурная реакция выделения ацетилена. Для ее замедления допустимо использовать поваренную соль (формула NaCl).
В промышленных условиях все несколько сложнее. Для производства ацетилена применяют пиролиз метана, а так же пропана, бутана. В последнем случае формула ацетилена будет содержать большое количество примесей.
Карбидный способ производства ацетилена обеспечивает производство чистого газа. Но, такой метод получения продукта должен быть обеспечен большим количеством электроэнергии.
Пиролиз не требует большого количества электричества, все дело в том, что для производства газа, необходимо выполнить нагрев реактора и для этого используют газ, циркулирующий в первом контуре реактора. Но в потоке, который там перемещается, концентрация газа довольно мала.
Выделение ацетилена с чистой формулой во втором случае не самая простая задача и ее решение обходится довольно дорого. Существует несколько способов производства формулы ацетилена в промышленных условиях.
Электрический крекинг
Превращение метана в ацетилен происходит в электродуговой печи, при этом ее нагревают до температуры в 2000-3000 °С. При этом, напряжение на электродах достигает 1 кВ. Метан разогревают до 1600 °С. Для получения одной тонны ацетилена необходимо затратить 13 000 кВт×ч. Это существенный недостаток производства формулы ацетилена.
Технологическая схема крекинга
Пиролиз окислительный
Этот способ основан на перемешивании метана и кислорода. После производства смеси, часть ее отправляют на сжигание и полученное тепло отправляют на нагревание сырья до температуры в 16000 °С. Такой процесс отличается непрерывностью и довольно скромными затратами электрической энергии. На сегодня этот метод чаще всего можно встретить на предприятиях по производству ацетилена.
Технологическая схема процесса окислительного пиролиза
Кроме перечисленных технологий производства формулы ацетилена применяют такие как — гомогенный пиролиз, низкотемпературную плазму. Все они отличаются количеством энергетических затрат и в итоге разными характеристиками получаемого газа и его формулой.
Хранение и транспортировка ацетилена
Ацетилен выпускают по ГОСТ 5457 растворенным и газообразным. Хранят и транспортируют его в растворенном состоянии в специальных стальных баллонах по ГОСТ 949, заполненных пористой, пропитанной ацетоном массой. Ацетилен, растворенный в ацетоне не склонен к взрывчатому распаду.
Баллоны окрашены в серый цвет и надписью красными буквами «АЦЕТИЛЕН» на верхней цилиндрической части.
Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см 2 ), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см 2 ). При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м 3 газа при 20°С и 760 мм рт. ст.).
Давление ацетилена в полностью наполненном баллоне изменяется при изменении температуры следующим образом:
| Температура, °С | -5 | 5 | 10 | 15 | 20 | 30 | 40 | |
|---|---|---|---|---|---|---|---|---|
| Давление, МПа | 1,3 | 1,4 | 14 | 1,7 | 1,8 | 12 | 2,4 | 3,0 |
Другие требования техники безопасности можно узнать из статьи о классе опасности и мерах безопасности при работе с ацетиленом
Применение ацетилена при сварке
Ацетилен – основной горючий газ, используемый при газовой сварке, а также широко применяется для газовой резки (кислородной резки). Температура ацетилено-кислородного пламени может достигать 3300°C. Благодаря этому ацетилен по сравнению с более доступными горючими газами (пропан-бутаном, природным газом и др.) обеспечивает более высокое качество и производительность сварки.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л. Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков. Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Электронное строение молекулы ацетилена
Структурная формула ацетилена имеет вид HC ≡ CH. Два атома углерода, связанные тройной связью, находятся в состоянии sp-гибридизации. Каждый такой атом имеет две sp-гибридные орбитали, расположенные под углом 180 o . За счет осевого перекрывания одной из этих орбиталей атом углерода образует σ-связь с другим атомом углерода, а за счет второй sp-гибридной орбитали — σ-связь с атомом водорода. σ-Скелет молекулы имеет линейное строение (рис. 1).
Рис. 1. Строение молекулы ацетилена.
Оставшиеся негибридизованными две p-орбиталикаждого атома углерода расположены под углом 90 o одна к другой. При боковом перекрывании этих орбиталей с соответствующими p-орбиталями другого sp-гибридизованного атома углерода образуются две π-связи, расположенные в двух взаимно перпендикулярных плоскостях.
Таким образом, тройная связь образуется из трех пар обобществленных электронов, т.е. это шестиэлектронная связь. Она представляет собой сочетание одной σ- и двух π-связей. π-Электронное облако тройной связи имеет вид цилиндра, охватывающего оба атома углерода.
Применение ацетилена
Применение ацетилена при газовой сварке обусловлено тем, что у него самая большая температуры горения. Но он также нашел свое применение в химической отрасли для получения пластмасс, синтетического каучука, уксусной кислоты и растворителей. Более подробный ответ по данному вопросу можно найти в статье о применении ацетилена.
Газ в баллоне
Для хранения и транспортировки ацетилена применяют газовые баллоны. Для изготовления этого устройства применяют бесшовную трубу, которую производят на основании ГОСТ 949-73. В нижней части корпуса устанавливают специальную опору, которая позволяет его устанавливать в вертикальное положение. В верхней части баллона устанавливают вентиль, через который выполняют заправку/отдачу газа. Эти вентили выпускают под маркой ВБА-1 или BA-I. Их применение допустимо только на баллонах предназначенном для хранения этого газа.
Ацетилен в баллонах
На поверхности баллона должны быть выбиты следующие данные:
Товарный знак производителя, дата производства, параметры давления и некоторые другие, которые характеризуют это изделие.
На поверхность баллонов наносят краску белого цвета. Кроме этого, в обязательном порядке должны быть нанесена надпись АЦЕТИЛЕН. При этом высота шрифта не должна быть менее 6 см.
Баллон заполняют пористым наполнителем. Его задача более равномерное распределение газа внутри баллон, другая задача заключается в предохранении газа от распада.
Ацетилен, строение, физические и химические свойства
Южно-Якутский технологический колледж
Дисциплина: Органическая химия
Тема: Ацетилен, строение, физические и химические свойства.
Учебная цель: Продолжить формирование у студентов понятия о кратных связях, познакомить с тройной связью между атомами углерода и её электронным строением. Сформировать представление о физических и химических свойствах ацетилена на основе его строения и в сопоставлении со свойствами этилена. Закрепить умения выводить формулы органических веществ по массовым долям элементов.
Развивающая цель: Продолжить развитие представлений о взаимном влиянии атомов в молекулах ацетиленовых углеводородов.
Воспитательная цель: Воспитание убеждённости в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде.
Оборудование: Мультимедийный проектор. Диск «Строение органических веществ», таблица «Строение С2Н2«, карточки-задания, модели строения молекул ацетилена и этилена, пластилин.
Реактивы: CaC2, воронка делительная, колба 250 мл, оборудование для получения ацетилена, кристаллизатор со снегом, штатив, раствор KMnO4, Br2 /Н2О.
Опрос. 3 студентов работают у доски.
Карточка № 1
1. Какой объем водорода выделится при каталитическом получении дивинила из 1 м 3 бутана (н.у.).
2. Будут ли иметь цис- транс — формы каучуки СКД (дивиниловый) и фторкаучук.
доказать, написав цис- транс формы.
Карточка № 2
1. Перечислить основные направления в развитии производства синтетических каучуков. Назвать виды сырья для получения каучука (подтвердить уравнениями реакций).
Карточка № 3.
1. Вулканизация каучука (изобразить схемой).
(С места по карточкам работают 2 студентов).
Карточка № 4.
1. Свойства и строение натурального каучука.
Карточка № 5.
1. Дать определение диеновых углеводородов, перечислить их свойства.
Фронтальный опрос:
- Какие вам известные синтетические каучуки?
- В чем отличие каучуков стереорегулярного строения и нестереорегулярного? Примеры.
- Какие различия в свойствах резины и каучука вы можете отметить? Чем объяснить это различие?
- Что такое эбонит?
Подведение итогов опроса.
Изучение нового материала.
Беседа по вопросам.
- Как построена молекула С2Н4?
- Какой тип гибридизации электронных облаков углеродных атомов в молекуле этилена?
- Чем отличается сигма-связь от пи-связи?
- Какова длина связи С=С в молекуле этилена и валентный угол между направлениями связей?
Ацетилен.
Вывод молекулярной формулы ацетилена. Задачу студент решает у доски.
При горении 5,2 г газообразного вещества образовалось 8,96 л СО2 (н.у.) и 0,2 M H2O. Д (Н)=13. Найти молекулярную формулу вещества.
Ответ:молекулярная формула ацетилена — С2Н2.
Демонстрация электронной и структурной формул молекулы С2Н2, проволочной модели С2Н2. Студенты делают сравнения со строением молекулы этилена.
В молекуле ацетилена у каждого атома углерода по 1 электрону идет на образование сигма- связи и по 2 электрона на образование 2 пи-связей. Тип гибридизации -sp.
Самостоятельная работа: Студенты изготавливают из пластилина шаростержневую модель С2Н2.
Вопрос: Изменяется ли расстояние между атомами углерода по сравнению со связями С — С в этане , С=С в этилене С2Н4? (студенты показывают сближение атомов углерода, большее сплющивание шариков).
Для сравнения студенты заполняют самостоятельно таблицу. Один студент работает у доски.
Ацетилен тип химической связи
Ацетиленовые углеводороды (алкины)
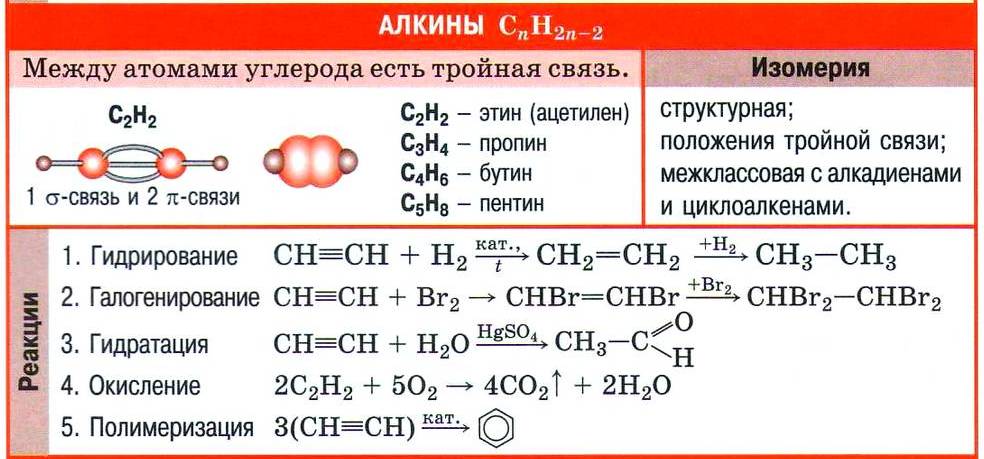
Ключевые слова конспекта: Ацетиленовые углеводороды (алкины). Межклассовая изомерия. Карбидный и метановый способы получения ацетилена. Винилхлорид. Поливинилхлорид. Реакция Кучерова.
Гомологический ряд алкинов
Как правило, любое научное открытие не только имеет теоретическую ценность, но и находит практическое применение. В химической науке есть немало примеров того, как практическое использование свойств вновь открытых веществ приводило к созданию новых материалов или технологий.
В 1836 г. английский химик Эдмунд Дэви предложил для газовых фонарей, освещавших улицы в те времена, особый «светильный газ», который горел красноватым коптящим пламенем. Четверть века спустя французский химик М. Бертло определил формулу светильного газа — С2Н2. Вскоре это вещество получило своё общепринятое (тривиальное, т. е. исторически сложившееся) название — ацетилен. В конце XIX в. французский химик Анри Ле Шателье сделал важное открытие: при горении ацетилена в чистом кислороде
температура пламени достигала 3100 °С, что в 2 раза выше температуры плавления железа! Это свойство кислородно-ацетиленового пламени используют и сейчас при газовой резке и сварке металлов.
В XX в. было установлено строение молекулы ацетилена. Как оказалось, в ней два атома углерода связаны тройной углерод-углеродной связью:
H—C≡C—H
Ацетилен — первый представитель гомологического ряда ацетиленовых углеводородов.
| Углеводороды с общей формулой СnН2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С, называют ацетиленовыми углеводородами или алкинами . |
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура и изомерия алкинов
Принадлежность углеводорода к алкинам обозначают суффиксом -ин, который указывает на тройную углерод-углеродную связь в молекуле. За основу названия алкина берут корень названия соответствующего алкана. Так, ацетилен в соответствии с номенклатурой ИЮПАК называют этином.
Формулы некоторых алкинов и их названия приведены в таблице.
Для алкинов, как и для алкенов, характерна изомерия положения кратной (тройной) связи. Например, изомерны бутин-1 и бутин-2.
Кроме этого, следует учесть, что гомологический ряд алкинов имеет такую же общую формулу, как и ещё один гомологический ряд уже знакомых вам углеводородов (алкадиенов): CnH2n–2. Такой вид структурной изомерии называют межклассовой изомерией.
Способы получения ацетилена
Рассмотрим способы получения важнейшего представителя класса алкинов — ацетилена.
Карбидный способ основан на взаимодействии карбида кальция с водой:
В промышленности карбид кальция получают сплавлением оксида кальция (негашёной извести) с коксом (углеродом):
Оксид кальция получают обжигом известняка по реакции:
В промышленном масштабе ацетилен получают метановым методом — пропусканием газообразного метана в специальных реакторах через зону с высокой (1500 °С) температурой:
Химические свойства алкинов
Тройную связь в молекулах алкинов обнаруживают с помощью двух качественных реакций — обесцвечивания бромной воды и раствора перманганата калия.
Непредельный характер алкинов обусловливает и наиболее характерные реакции веществ этого класса — реакции присоединения, которые протекают в две стадии. Например, реакция бромирования ацетилена:
Реакцию присоединения галогеноводородов к алкинам мы рассмотрим на примере важной в практическом отношении реакции хлороводорода с ацетиленом:
Хлорэтен называют также винилхлоридом, потому что одновалентный радикал этилена СН2=СН— носит название винил. Хлорэтен — исходное вещество для получения ценного полимера поливинилхлорида. Уравнение реакции полимеризации хлорэтена выглядит так:
Как и этилен, ацетилен вступает в реакцию гидратации, т. е. присоединяет воду. Однако отличие тройной углерод-углеродной связи от двойной отражается на строении продукта реакции гидратации. Схематично присоединение воды к ацетилену можно изобразить так:
или
Реакция гидратации ацетилена названа в честь русского учёного-химика Михаила Григорьевича Кучерова, предложившего для проведения этого процесса использовать в качестве катализатора соли ртути(II). Продукт реакции Кучерова — органическое вещество уксусный альдегид. До середины XX в. реакция Кучерова лежала в основе промышленного получения уксусного альдегида, но в настоящее время её не используют из-за токсичности солей ртути. Получение уксусного альдегида по реакции Кучерова было вытеснено так называемым Вакер-процессом — получением ацетальдегида прямым окислением этилена в присутствии катализатора — хлорида палладия(II).
Ацетилен применяют в органическом синтезе. Он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают органические растворители. Ацетилен до сих пор используют для газовой сварки и резки металлов.
Таблица «Ацетиленовые углеводороды (алкины)»
Конспект урока по химии «Ацетиленовые углеводороды (алкины)». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: