Ацетилен
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
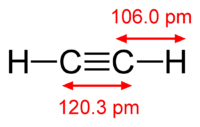
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(H-C(O)H) = 30 г/моль;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Ацетилен
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
- ↑ 12ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑В России разработали ракетный двигатель на аммиаке — Известия
Ссылки
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб. , 1890—1907.
| Углеводороды | |
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан . |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен . |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
- Алкины
- Взрывчатые вещества
- Продукция основного органического синтеза
- Газы
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Ацетилен» в других словарях:
АЦЕТИЛЕН — АЦЕТИЛЕН, имеет химич. формулу С2Н2 (формула строения НС • СН) и представляет собой при обыкновенных условиях бесцветный ядовитый газ, при 0° и 26 атм. сгущающийся в жидкость. 1 л А. при 0° и 760 мм весит 1,165 г. При обыкновенной… … Большая медицинская энциклопедия
Ацетилен — – химически чистый ацетилен представляет собой бесцветный газ со слабым эфирным запахом. Технический ацетилен имеет резкий специфический запах вследствие наличия в нем примесей, в частности, фосфористого водорода. Ацетилен – слабый… … Энциклопедия терминов, определений и пояснений строительных материалов
АЦЕТИЛЕН — Газообразный углеводород, употребляемый как осветительный материал. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. АЦЕТИЛЕН горючий газ (углеводород) пронзительного запаха; образуется при неполном сгорании… … Словарь иностранных слов русского языка
ацетилен — а, м. acétylène m. <лат. acet ( um ) уксус и фр. ethylene. Бесцветный горючий газ с характерным запахом, применяемый при газовой сварке и резке металлов, для получения синтетических полимеров и. д. БАС 2. Бертело, которому ацетилен обязан… … Исторический словарь галлицизмов русского языка
ацетилен — диссугаз, этин Словарь русских синонимов. ацетилен сущ., кол во синонимов: 4 • алкен (6) • газ (55) … Словарь синонимов
АЦЕТИЛЕН — АЦЕТИЛЕН, HCуCH, бесцветный горючий газ, tкип 83,8шС. Получают пиролизом природного метана и действием воды на карбид кальция. Горючее при сварке и резке металлов; сырье в органическом синтезе … Современная энциклопедия
АЦЕТИЛЕН — НС СН, бесцветный газ, tкип = 84,1 .С. Получают из природных газов или карбида кальция. Сырье для синтеза винилхлорида, акрилонитрила, ацетальдегида, винилацетата и др.; горючее при сварке и резке металлов … Большой Энциклопедический словарь
АЦЕТИЛЕН — АЦЕТИЛЕН, см. ЭТИН … Научно-технический энциклопедический словарь
АЦЕТИЛЕН — АЦЕТИЛЕН, ацетилена, мн. нет, муж. (от лат. acetum уксус) (хим., тех.). Горючий, бесцветный газ, состоящий из углерода и водорода. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
АЦЕТИЛЕН — АЦЕТИЛЕН, а, муж. Бесцветный горючий газ, соединение углерода с водородом. | прил. ацетиленовый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Ацетилен, получение, свойства, химические реакции

Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород , состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода .
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород , сероводород и пр., которые придают ему резкий запах.
Легче воздуха . Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ . Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом , метаном или пропаном .
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух , может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны , заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде . Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
Реакция протекает стадийно с образованием производных алканов .
В ходе данной реакции ацетилен обесцвечивает бромную воду .
- 2. гидрогалогенирование ацетилена:
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, t o = 450-500 о С).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 о С.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 ( этилен ) (kat = Ni, Pd или Pt, повышенная t o );
СH≡CH + 2Н2 → C2H6 ( этан ) (kat = Ni, Pd или Pt, повышенная t o ).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
- 2. дегидрирования метана:
- 3. дегидрирования этилена:
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (t o = 900-1200 о С).
Затем получают карбид кальция , сплавляя оксид кальция и кокс в электро печах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (t o = 2500-3000 о С).
Далее карбид кальция обрабатывают водой по известной реакции.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы .
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь , в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа ( аргона или водорода ).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей , пластических масс, синтетических каучуков , ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода ,
– как источник очень яркого, белого света в автономных светильниках , где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см 2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см 2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами , например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью , серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы , содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен