Ацетилен реагирует с водой
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой СnH2n-2. Первый член гомологического ряда – этин или ацетилен.
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
- Реакции пиролиза метана или этана
При пиролизе метана необходимо строго выдерживать время реакции. Для этого используется “закалка” — быстрый ввод на выходе реакционной зоны воды.
- Карбидный метод
CaC2 + 2H2O ® C2H2 + Ca(OH)2
Аналогично реагируют карбиды стронция и бария SrC2, BaC2.
Карбид магния с водой образует пропин
- Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
- Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
Физические свойства алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17 , алкины являются кристаллическими веществами.
Тройная связь представляет собой одну s -связь С-С и две p -связи. При переходе от двойной к тройной связи средняя энергия p -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RC º C = 5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации. Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена. Это обусловливает более высокую электрофильность алкенов по сравнению с алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных групп.
В электронных спектрах поглощения алкины имеют полосу поглощения при 170-180 нм, что соответствует p — p * — переходу. В ИК спектрах характерны валентные колебания связи С º С при 2100-2260 см -1 и связи º С-Н при 3270-3330 см -1 .
В спектрах ПМР химический сдвиг атома водорода º С-Н равен 1,7-2 м.д.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия p -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
- Реакция гидрирования.
Реакция имеет ступенчатый характер:
Сat: металлические Ni, Pl, Pd.
На первой стадии количественно образуется алкен, и после практического исчерпывания алкина начинается гидрирование алкена. Это связано с более высоким сродством алкинов к поверхности катализатора. Обычно реакция протекает нестереоселективно и образуется смесь цис- и транс-продуктов присоединения.
Модификация катализаторов приводит к стереоселективному синтезу. Так, промотируя палладий оксидом свинца (II) и CaCO3, получают катализатор Линдлара, на котором осуществляется стереоспецифичный синтез цис-изомера.
Химия. УГЛЕВОДОРОДЫ.
В скором будущем (завтра) зачет по данной теме, решить не в состоянии, кто-нибудь, хоть что-нибудь, Вам будут благодарны 26 юных «химиков».
хим свойства алкинов ( смотрю в учебник 10го класса )
для ацетилена и его гомологов характерны реакции присоединения, окисления и полимеризации (аналогично углеводородам ряда этилена )
*1) ***реакции присоединения: *-углеводороды ряда ацетилена реагируют с галогенами. например, ацетилен обесцвечивает бромную воду. присоединение брома происходит в две стадии:
HC(тройная связь) CH + Br2 —> CHBr(двойная) CHBr 1.2-дибромэтан
CHBr(2я) CHBr+Br2 —> CHBr2(1я) CHBr2 1,1,2,2-тетрабромэтан
2) при небольшом нагревании (25 градусов цельсия) в присутствии катализаторов ( никеля, или платины, или палладия) ацетилен присоединяет водород. гидрирование ацетилена подобно бромированию тоже происходит в 2 стадии.
СН (3я) СН + H2 -(t, kat.)-> CH2(2я) CH2
CH2(2я) CH2 + H2 -(t, kat.)-> CH3(1)CH3
3)ацетилен реагирует также со сложными в-вами. например в присутствии сульфата ртути (II) ацетилен присоединяет воду (гидратируется) , и образуется ацетатальдегид (уксусный альдегид) :
Н-С (3)-Н + НОН —HgSO4—> CH3-C(-H)=O реакция Кучерова
если к ацетилену присоединяется хлороводород, то образуется газообразное в-во винилхлорид, или хлорвинил. катализатор- AlCl3
*2)***реакции окисления: *-ацетилен обесцвечивает раствор перманганата калия. следовательно ацетилен (как и этилен) легко окисляется.
при этом могут образоваться разные продукты, однако ацетилен может полностью окислиться до СО2 и Н2О:
3CH(3я) CH + 10KMnO4 + 2H2O —> 6CO2+ 10MnO2(стрелка вниз) + 10KOH
2) на воздухе ацетилен горит коптящим плаенем. если при горении дополнительно вдувать воздух, то он сгорает полностью без копоти.
2С2Н2 + 5О2 = 4СО2+ 2Н2О
*3)*** реакции полимеризации. ацетилен может полимеризоваться в бензол и винилацетилен.
p.s второе не хочется делать, но 3е не такое уж сложное. если что-то еще. . обращайтесь. . хотя с органикой у меня не оч)
3. 100%-85.71%=14.92% Mr=14*3=42 C_H=85,71/12:14,92/1=1:2=2:4=3:6 С3Н6-пропен
Ну, первое задание можно спокойно в учебнике найти, там просто специфику реакций надо рассказать.
2.
1) Al4C3 +12 H2O =4 Al(OH)3 + 3CH4
2) CH4 + Cl2 —свет—> CH3Cl + HCl
3) CH3Cl + 2Na + ClCH3 = C2H6 + 2NaCl
4) C2H6 + Br2 = C2H5Br + HBr
5) C2H5Br + 2Na + BrC2H5 = C4H10 + 2NaBr
6) C4H10 —AlCl3—> C3H7(CH3)
Задача.
Пусть масса углеводорода равна 100г, тогда
m(C) = 85,71г
n(C) = 85,71/12 = 7 моль
m(H) = 100 — 85,71 = 14,29г
n(H) = 14,29/1 = 14моль
C7H14 — простейшая формула.
M(C7H14) = 98г/моль
M (итсинная) = 3*28 = 84г/моль
М (ист. ) : М (C7H14) = 84:98 = 6:7
С6H12 — истинная формула.
Ответ: С612
Ацетилен: свойства, получение и применение
В прошлом ацетилен получали путем пиролиза карбида кальция. Сейчас же применяются более экономичные способы, к примеру, сжигание метана в кислородной смеси. Это позволяет получать газ в концентрации до 99,2%. Также для производства ацетилена может использоваться метод разложения жидких нефтепродуктов путем электролиза.
Полученный газ не имеет специфического запаха. Он не растворяется в воде и весит меньше воздуха. Температура его кипения составляет около -84 градусов Цельсия. Следует учитывать, что при попытке сжатия ацетилен разлагается путем взрыва. Выпускать этот газ на открытый воздух нельзя. Для его хранения используются баллоны, заполненные активированным углем либо кизельгуром.
Нельзя допускать контакта газа с водой, особенно совместно с солями ртути. Это приводит к преобразованию ацетилена в уксусную кислоту. Также его нельзя подвергать нагреву до температуры свыше 500 градусов: это может привести к взрыву. При соблюдении правил безопасности, например, в процессе сварки, этого можно избежать. Для уменьшения уровня взрывоопасности ацетилена его нередко разбавляют другими газами. Как правило, для этих целей используется метан или пропан.
Ацетилен активно используется во множестве различных сфер деятельности. Он особенно востребован при проведении сварочных работ, а также при резке, наплавке и других видах обработки металлических заготовок. Кроме того, ацетилен является исходным веществом, использующимся для получения некоторых видов пластмасс, синтетического каучука, уксусной кислоты, разнообразных растворителей (в том числе ацетона), этилового спирта, взрывчатки и т. д.
Наша компания также предлагает широкий выбор поверочных газовых смесей.
Самое хаотическое вещество Вселенной
Согласно самой простой классификации, газы делятся на группы: газы-окислители, инертные и горючие газы.
Окислители сами по себе не горят, но в комбинации с другими веществами или газами, могут превратиться в легковоспламеняющуюся или даже взрывоопасную смесь. Достаточно вспомнить, как горит в кислороде дерево, или негорящий в обычном воздухе марганец. К газам этой группы относят двуокись азота NO2, окись азота NO, кислород, фтор и хлор.
Вторую группу составляют нейтральные, или инертные газы. Как и следует из самого слова, они никак не взаимодействуют с другими газами, не горят, и не поддерживают горение. В замкнутых пространствах такие газы могут даже замедлять горение и тушить огонь. Поэтому их можно использовать для ликвидации пожаров там, где невозможно тушить водой. Это азот, аргон, гелий, ксенон и неон.
Третья группа — самые активные, горючие газы, которые при взаимодействии с воздухом могут быть даже взрывоопасны — все зависит от концентрации смеси. Это аммиак, ацетилен, водород, бутан, метан, этан пропилен, этил и другие газы.;
И, наконец, четвертая группа – это газовые смеси для разных целей:
- поверочные смеси для калибровки газоанализаторов и хроматографов,
- технические смеси для решения самых разнообразных задач в хозяйстве и производстве.
Многоуважаемый господин баллон!
Газовый баллон прост на вид. Нам всем приходилось иметь дело и с баллончиками для сифона, и с красными баллонами, в которых перевозят пропан для приготовления пищи. Кто-то видел возле строек синие кислородные и белые ацетиленовые баллоны.
При видимой простоте, баллон — это сумма высоких технологий, которые обеспечивают не только сохранность смеси газов, но и безопасность нашей жизни и работы.
Многообразие сосудов, с помощью которых перевозят, хранят и эксплуатируют различные газы, может потрясти воображение обычного человека. Специалист же, при беглом взгляде на баллон, моментально скажет, что за газ там прописан.
Технологии хранения газов маркировки баллонов — это целая наука.
Желтая надпись на черном баллоне недвусмысленно свидетельствует, что здесь — азот. Гелий, которым надувают воздушные шарики, перевозят в коричневых баллонах с белой надписью. «Враг озонового слоя» фреон транспортируют в серебристых баллонах. Однако внешних признаков отличия недостаточно. Каждый уважающий себя баллон должен иметь специальный паспорт. Как правило, это все необходимые сведения, которые выбиты на корпусе, возле горловины. Здесь указаны: дата производства, масса баллона, даты аттестаций. Вся информация, чтобы сделать вывод о пригодности баллона к эксплуатации. Если надпись не предусмотрена на корпусе, она выбивается на специальном металлическом шильдике, возле горловины. Баллоны бывают новые и переосвидетельствованные. Новые только что сошли с заводского конвейера, они не потребуют аттестации и проверки в течение ближайших пяти лет.
Считается, что при использовании и транспортировке газов в промышленных объемах, да и в быту, лучше использовать только новые баллоны. Но это спорная точка зрения. Конечно, у нового баллона в запасе еще 40 лет ресурса, они не загрязнены влагой, на них нет неровностей и ржавчины.Однако, новые баллоны дороже почти вдвое, чем их побывавшие в употреблении и прошедшие переосвидетельствование собратья. И цена превращается в главный аргумент. Даже вы закупили партию новых баллонов, не стоит забывать, что при перезаправке вы можете получить совершенно другие баллоны с нужным газом. Тогда зачем переплачивать?
И самое главное
Ремонтировать, окрашивать и наполнять газом баллоны имеют право только специализированные организации, у которых имеются документы, разрешающие ремонтные работы с сосудами, работающими под высоким давлением. Если вам впервые предстоит заключать контракт на поставку технических газов или поверочных газовых смесей, обязательно узнайте, есть ли у компании лицензия на проведение подобных работ, и какие конкретно виды деятельности в ней указаны.
Ацетилен вода и hg2
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Изомерия и номенклатура
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
2. Изомерия углеродного скелета (начиная с С5Н8):
3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
5. Химические свойства алкинов
I. Реакции присоединения
1). Галогенирование – стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
Гидрогалогенирование
* – используется пр. Морковникова
3). Гидратация – ( р. М.Г. Кучерова)
спирт – енол альдегид
протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:
Какое из указанных веществ при взаимодействии с водой в присутствии солей ртути образует альдегид?
Все алкины, кроме этина(ацетилена) при взаимодействии с водой в присутствии солей ртути образуют кетоны и только этин – альдегид.
Общие сведения
Ацетилен — ненасыщенный углеводород C 2 H 2 . Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле практически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Впервые газообразный ацетилен получил в 1836 г. Эдмунд Дэви при разложении водой карбида калия, полученного при сплавлении металлического калия с углем: К 2 С 2 + 2Н 2 О = С 2 Н 2 + 2КОН.
С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (CaC 2 + 2H 2 O = C 2 H 2 + Ca(OH) 2 , который в свою очередь получали прокаливанием смеси угля и негашеной извести (СаО + 3С = СаС 2 + СО), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Физические свойства
При нормальных условиях — бесцветный газ, запах которого напоминает запах чеснока, малорастворим в воде, легче воздуха. Чистый ацетилен при охлаждении сжижается при -83,8°С, а при дальнейшем понижении температуры быстро затвердевает. Он умеренно растворим в воде (1150 мл в 1 л воды при 15°С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм). Термодинамически ацетилен неустойчив: он взрывается при нагревании до 500° С, а при обычной температуре – при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Химические свойства
Для ацетилена (этина) характерны реакции присоединения, димеризации, полимеризации, цикломеризации.
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м3. При сгорании температура пламени достигает 3300°С (5972 °F). Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди. Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция , а также при дегидрировании двух молекул метана при температуре свыше 1400°C.
Применение
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами — с кислородом и с ацетиленом. Газы из баллонов поступают в специальную горелку. При сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3200° С) достигается при содержании ацетилена 45% по объему. В таком пламени очень быстро расплавляются даже толстые куски стали.
Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (карбидка).
Ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной. Ацетилен – реакционноспособное соединение, вступающее в многочисленные реакции. Химия ацетилена богата. Из него можно получить сотни разнообразных соединений.
Он используется в производстве взрывчатых веществ (ацетилениды), для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Преимущества ацетилена при газопламенной обработке металлов
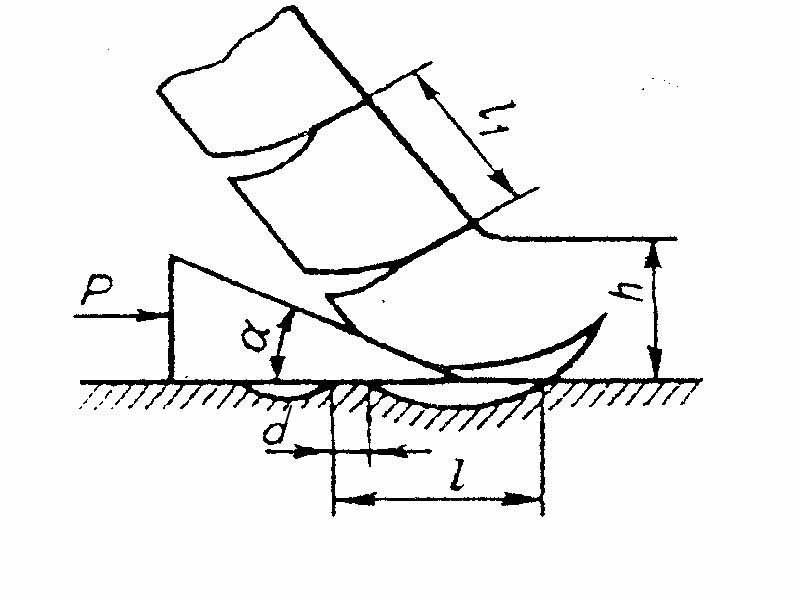
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и тд.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3200 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Сравнительные характеристики пламени при сварке различным газами
| Газ | Температура пламени, °C |
| Ацетилен | 3000 – 3200 |
| МАФ | 2930 |
| Пропан | 2600-2750 |
| Водород | 2100-2500 |
| Метан | 2000-2200 |
Хранение и перевозка ацетилена
Хранят и перевозят ацетилен в заполненных инертной пористой массой (древесным углем или литой пористой массой) стальных баллонах белого цвета (с красной надписью «АЦЕТИЛЕН») в виде раствора в ацетоне под давлением 1,5-2,5 МПа. Растворенный ацетилен в баллонах перевозят всеми видами транспорта в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта.
Опасные факторы и меры безопасности
Ацетилен – взрывоопасный газ. С воздухом образует взрывоопасную смесь. Температура самовоспламенения ацетилена 335°С. Температура воспламенения ацетилено-воздушных смесей 305-470°С, ацетилено-кислородных 297-306°С,
При хранении ацетилена и его применении необходимо заботиться о достаточной вентиляции и учесть правила классификации электрооборудования. Открытое пламя и курение категорически запрещены.
Ацетилен обладает слабым токсическим действием. При длительном вдыхании технического ацетилена появляется рвота и головокружение.
Ацетилен взрывоопасен при следующих условиях:
– при нагреве до 450-500°С и одновременном повышении давления от 1,5 –2,0 атмосфер ацетилен взрывается без внешнего источника воспламенения;
– в смеси с воздухом, если в воздухе содержится ацетилена в пределах от 2,3–80,7% по объему;
– в смеси с кислородом, если ацетилена содержится в пределах от 2,3-93% по объему;
– ацетилено-воздушные и ацетилено-кислородные смеси взрываются при наличии искры, открытого огня, нагретой поверхности или какого-либо другого источника воспламенения.
– при длительном соприкосновении ацетилена с красной медью и серебром образуются взрывчатые соединения, которые взрываются при ударе и повышении температуры;
– при контакте с водой ацетилен способен образовывать твердый кристаллогидрат, представляющий собой кристаллическое вещество белого цвета, напоминающий снег или лед.
Все применяемые материалы, в т.ч. неметаллические части, как, например, заглушки вентилей, прокладки и мембраны должны обладать стойкостью к ацетилену и его растворителям.
Ацетиленовая проводка должна быть стальной. Детали, изготовленные из серебра, меди или сплава, содержащего более 65% меди, нельзя применять из-за опасности образования взрывоопасных соединений меди и ацетилена.